

Πότε έρχεται η επεξεργασία γονιδιώματος για όλους;
ΚΟΙΝΩΝΙΑΥΓΕΙΑ 26 Φεβρουαρίου 2023 fonisalaminas

Tο CRISPR – η τεχνολογία γονιδιακής επεξεργασίας που ανέπτυξαν οι ερευνήτριες Τζένιφερ Ντούντνα (Jennifer Doudna) και Εμανουέλ Σαρπεντιέ (Emmanuelle Charpentier), οι οποίες κέρδισαν το βραβείο Νόμπελ το 2020 για το επίτευγμά τους – είναι αναμφισβήτητα μια επαναστατική καινοτομία με αμέτρητες δυνατότητες. Βασισμένη σε δεκαετίες έρευνας, η τεχνολογία CRISPR επιτρέπει στους ερευνητές να τροποποιούν και να επιδιορθώνουν γονίδια σχεδόν σε κάθε ζωντανό οργανισμό – συμπεριλαμβανομένων των ανθρώπων, των φυτών και των ζώων.
Οι εξελίξεις στην επεξεργασία του γονιδιώματος θα μπορούσαν να διευρύνουν δραματικά το πεδίο εφαρμογής των θεραπειών γονιδιακής επεξεργασίας, καθιστώντας τις δυνητικά διαθέσιμες σε πολύ περισσότερους ανθρώπους και για ένα πολύ ευρύτερο φάσμα διαταραχών.

Το CRISPR λειτουργεί ως μοριακό ψαλίδι «κόβοντας και ράβοντας» το γονιδίωμα διαφορετικών οργανισμών. Σήμερα, οι επιστήμονες τo δοκιμάζουν για να αλλάξουν τον γενετικό κώδικα, ακόμη και με την εισαγωγή ολοκαίνουργιων τμημάτων DNA ή ενδεχομένως ολόκληρων γονιδίων στο γονιδίωμα ενός ατόμου. Αυτές οι νέες τεχνικές σημαίνουν ότι το CRISPR θα μπορούσε ενδεχομένως να βοηθήσει στη θεραπεία πολύ περισσότερων παθήσεων οι οποίες δεν είναι όλες γενετικές. Για παράδειγμα, τον Ιούλιο του 2022, η αμερικανική εταιρεία γενετικών φαρμάκων, Verve Therapeutics, ξεκίνησε κλινική δοκιμή μιας θεραπείας που χρησιμοποιεί την τεχνική CRISPR για να αλλάξει τον γενετικό κώδικα για να μειώσει μόνιμα τα επίπεδα χοληστερόλης ενός ασθενούς.
Ο πρώτος ασθενής που θα λάβει την θεραπεία είναι ένας εθελοντής από τη Νέα Ζηλανδία, ο οποίος έχει κληρονομική προδιάθεση για υψηλή χοληστερόλη και πάσχει ήδη από καρδιακή νόσο. Οι επιστήμονες θα απενεργοποιήσουν μόνιμα ένα γονίδιο που κωδικοποιεί την πρωτεΐνη PCSK9, η οποία φαίνεται ότι παίζει ρόλο στη διατήρηση των φυσιολογικών επιπέδων χοληστερόλης στο αίμα.
Ο Κίραν Μουσουνούρου, συνιδρυτής και ανώτερος επιστημονικός σύμβουλος της Verve Therapeutics, πιστεύει ότι η τεχνική αυτή θα μπορούσε να βοηθήσει σχεδόν οποιονδήποτε.
«Ακόμη και αν έχετε φυσιολογικά επίπεδα χοληστερόλης και απενεργοποιήσετε την PCSK9 και στη συνέχεια μειώσετε ακόμη περισσότερο τα επίπεδα χοληστερόλης, αυτό μειώνει τον κίνδυνο καρδιακής προσβολής», εξήγησε ο Μουσουνούρου. «Πρόκειται για μια γενική στρατηγική που θα μπορούσε να ωφελήσει όλους».
Η εξέλιξη του CRISPR
Όπως αναφέρει το MIT Technology Review, οι θεραπείες που χρησιμοποιούν την τεχνική CRISPR δοκιμάζονται ήδη σε κλινικές δοκιμές με ανθρώπους. Πρόκειται για ένα εντυπωσιακό επίτευγμα αν αναλογιστεί κανείς ότι η τεχνική αυτή χρησιμοποιήθηκε για πρώτη φορά γπριν από περίπου 10 χρόνια.
«Ήταν ένα αρκετά γρήγορο ταξίδι», είπε ο Αλέξις Κόμορ από το Πανεπιστήμιο της Καλιφόρνιας στο Σαν Ντιέγκο, ο οποίος ανέπτυξε μερικές από αυτές τις νεότερες τεχνικές CRISPR.

Χάρη στην τεχνική CRISPR, οι επιστήμονες στοχεύουν συγκεκριμένες θέσεις στο DNA ενός ασθενούς και τις τροποποιούν προκείμενου να θεραπεύσουν μια κληρονομική ή επίκτητη ασθένεια. Η πρώτη γενιά CRISPR ουσιαστικά κόβει το DNA. Στη συνέχεια, τα κύτταρα επιδιορθώνουν την περιοχή εγκοπής και η διαδικασία αυτή συνήθως προστατεύει από μια επιβλαβή γενετική μετάλλαξη.
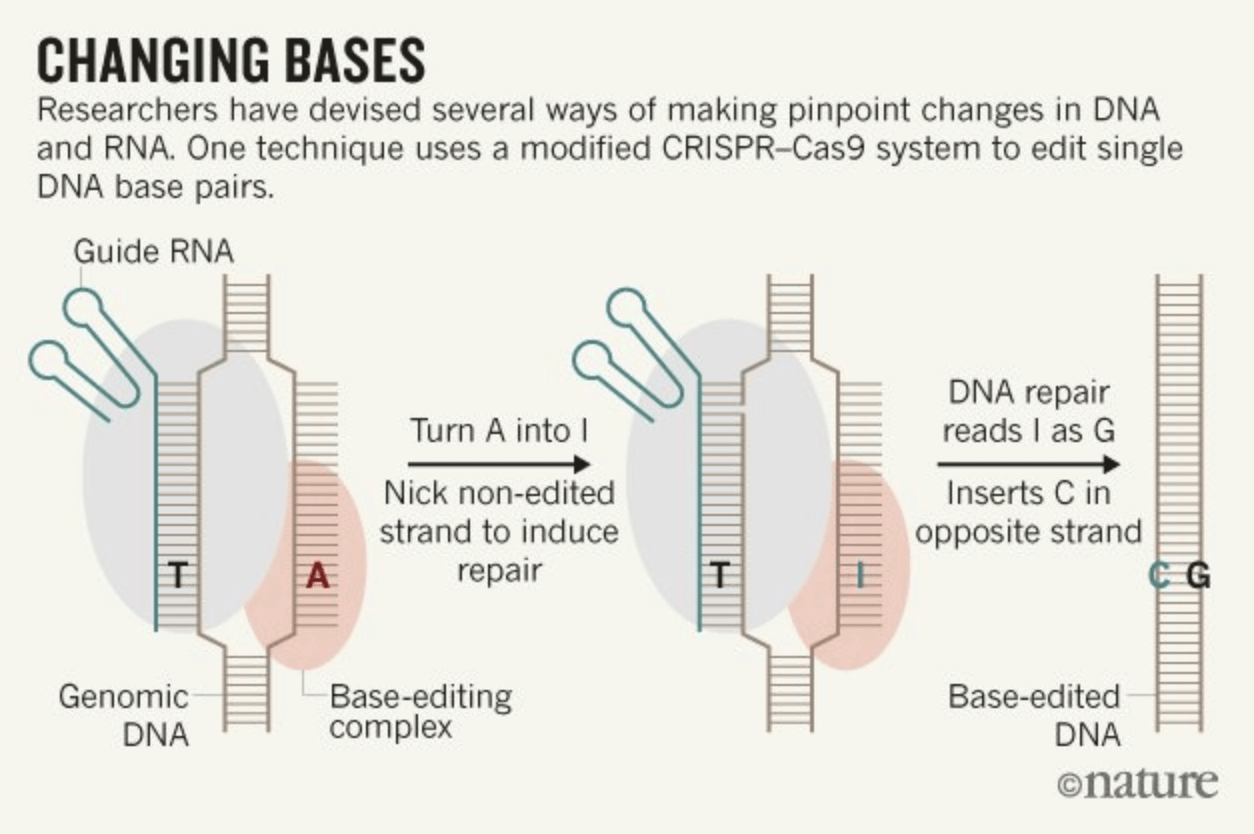
Οι νεότερες μορφές της τεχνολογίας CRISPR λειτουργούν με ελαφρώς διαφορετικούς τρόπους. Για παράδειγμα, ο επεξεργαστής βάσεων, γνωστός ως CRISPR 2.0, στοχεύει τα βασικά δομικά στοιχεία του DNA που ονομάζονται βάσεις. Η διπλή έλικα του DNA αποτελείται από τέσσερις αζωτούχες χημικές βάσεις ή «γράμματα»: την αδενίνη (A), τη γουανίνη (G), την κυτοσίνη (C) και τη θυμίνη (Τ). Αντί να κόψει το DNA, το CRISPR 2.0 μπορεί να μετατρέψει ένα γράμμα σε ένα άλλο.
«Δεν λειτουργεί πλέον σαν ψαλίδι, αλλά περισσότερο σαν μολύβι και γόμα», είπε ο Μουσουνούρου.
Η διαδικασία αυτή μπορεί να γίνει μόνο μια φορά και προς το παρόν είναι άκρως πειραματική, αλλά θα μπορούσε να συμβάλει στη μείωση των λιστών αναμονής για μεταμοσχεύσεις στο μέλλον.
Θεωρητικά, η επεξεργασία βάσεων θα είναι ασφαλέστερη από την αρχική τεχνική γονιδιακής επεξεργασίας CRISPR. Επειδή το DNA δεν κόβεται, υπάρχει μικρότερη πιθανότητα να αποκοπεί κατά λάθος ένα σημαντικό γονίδιο ή να επιδιορθωθεί το DNA με λάθος τρόπο.
Η θεραπεία της Verve Therapeutics για τη μείωση της χοληστερόλης χρησιμοποιεί επεξεργαστή βάσεων, όπως και αρκετές άλλες πειραματικές θεραπείες. Μια εταιρεία που ονομάζεται Beam Therapeutics, για παράδειγμα, χρησιμοποιεί την τεχνική αυτή για τη δημιουργία πιθανών θεραπειών για τη δρεπανοκυτταρική νόσο και άλλες διαταραχές.
Υπάρχει επίσης και η τεχνική prime editing, ή CRISPR 3.0, η οποία επιτρέπει στους επιστήμονες να αντικαθιστούν τμήματα DNA ή να εισάγουν νέα κομμάτια γενετικού κώδικα. Οι ερευνητές δοκιμάζουν αυτή την τεχνική εδώ και λίγα χρόνια σε εργαστηριακά ζώα. Αλλά οι δυνατότητές της είναι τεράστιες.
Οι τεχνικές CRISPR 1.0 και επεξεργασία βάσεων είναι κάπως περιορισμένες καθώς οι επιστήμονες μπορούν να τις χρησιμοποιήσουν μόνο είτε για να κόψουν το DNA ή είτε για να αλλάξουν ένα μόνο γράμμα. Το prime editing θα μπορούσε να επιτρέψει στους επιστήμονες να εισάγουν εντελώς νέα γονίδια στο γονιδίωμα ενός ατόμου.
Αυτό σημαίνει ότι θα μπορούσε να στοχεύσει πολύ περισσότερες γενετικές διαταραχές.
«Αν θέλετε να διορθώσετε μια συγκεκριμένη μετάλλαξη που είναι πέρα από την εμβέλεια της επεξεργασίας βάσεων, το prime editing είναι η μόνη σας επιλογή», σημείωσε ο Μουσουνούρου.
Εκατό άτομα που πάσχουν από μια διαταραχή μπορεί να έχουν όλων των ειδών τις γενετικές επιρροές που τους έκαναν ευάλωτους σε αυτή. Αλλά η εισαγωγή ενός διορθωτικού γονιδίου θα μπορούσε ενδεχομένως να τους θεραπεύσει όλους, σύμφωνα με τον Μουσουνούρου.
«Αν μπορούμε να εισάγουμε ένα νέο, φρέσκο, λειτουργικό αντίγραφο του γονιδίου, μπορεί να μην έχει σημασία τι μετάλλαξη έχει ο ασθενής», είπε. «Τοποθετούμε ένα λειτουργικό αντίγραφο και αυτό είναι αρκετά καλό», πρόσθεσε.
Σύμφωνα με τον Μουσουνούρου, οι ασθένειες-στόχοι δεν χρειάζεται καν να προκαλούνται από γενετικές μεταλλάξεις. Στην πραγματικότητα, ακόμη και ορισμένες από τις παλαιότερες τεχνικές CRISPR θα μπορούσαν να χρησιμοποιηθούν για τη στόχευση ασθενειών που δεν είναι απαραίτητα αποτέλεσμα ενός κακόβουλου γονιδίου. Η θεραπεία της Verve Therapeutics για τη μόνιμη μείωση της χοληστερόλης είναι από τα πρώτα παραδείγματα θεραπείας CRISPR που θα μπορούσε να ωφελήσει την πλειονότητα των ενηλίκων, σύμφωνα με την εταιρεία.
Γενετικά εμβόλια
Η προσέγγιση της εταιρείας περιλαμβάνει την αντικατάσταση ενός «γράμματος» στο γονίδιο που κωδικοποιεί την πρωτεΐνη PCSK9. Αυτό απενεργοποιεί το γονίδιο, οπότε παράγεται πολύ λιγότερη πρωτεΐνη. Επειδή η πρωτεΐνη αυτή παίζει σημαντικό ρόλο στη διατήρηση των επιπέδων της LDL χοληστερόλης -του τύπου που σχετίζεται με τις φραγμένες αρτηρίες– τα επίπεδα της χοληστερόλης πέφτουν επίσης.
Όταν οι ερευνητές χορήγησαν την θεραπεία σε ποντίκια και πιθήκους, τα επίπεδα χοληστερόλης στο αίμα τους μειώθηκαν κατά περίπου 60% με 70% μέσα σε λίγες ημέρες και παρέμειναν χαμηλά. Η εταιρεία εκτιμά ότι η πρώτη κλινική δοκιμή σε ανθρώπους θα διαρκέσει μερικά χρόνια. Στη συνέχεια, θα πρέπει να λάβει έγκριση από τον Αμερικανικό Οργανισμό Τροφίμων και Φαρμάκων (FDA).
«Θα περάσει αρκετός καιρός μέχρι να εγκριθεί πραγματικά η χρήση οποιασδήποτε θεραπείας CRISPR», είπε ο Μουσουνούρου.
Αλλά στο μέλλον, πρόσθεσε, ίσως μπορέσουμε να χρησιμοποιήσουμε την ίδια προσέγγιση για να προστατεύσουμε τους ανθρώπους από την υψηλή αρτηριακή πίεση και τον διαβήτη.
Ο Κόμορ πρότεινε ότι θα μπορούσε να αναπτυχθεί μια θεραπεία με την τεχνική CRISPR για την πρόληψη της νόσου Αλτσχάιμερ. Αλλά προειδοποίησε ότι η επεξεργασία των γονιδιωμάτων υγιών ανθρώπων εγείρει ηθικά ερωτήματα και θα μπορούσε να είναι ένα περιττό ρίσκο για ανθρώπους που κατά τα άλλα είναι καλά στην υγεία τους.
«Αν μου δινόταν η ευκαιρία να κάνω επεξεργασία των ηπατικών μου κυττάρων για να μειώσω τη χοληστερόλη ενδεχομένως στο μέλλον, μάλλον θα έλεγα όχι», είπε. «Θέλω να διατηρήσω το γονιδίωμά μου ως έχει, εκτός αν υπάρχει κάποιο πρόβλημα».
Οποιαδήποτε νέα θεραπεία πρέπει να είναι τουλάχιστον εξίσου ασφαλής με τις ήδη διαθέσιμες, συμπλήρωσε η Τάνια Μπουμπέλα, η οποία μελετά τις νομικές και ηθικές επιπτώσεις των νέων τεχνολογιών, στο Πανεπιστήμιο Simon Fraser στο Burnaby της Βρετανικής Κολομβίας.
«Πολλά φάρμακα έχουν παρενέργειες. Η διαφορά είναι ότι η φαρμακευτική αγωγή ενός ασθενούς μπορεί να αλλάξει. Με την γονιδιακή επεξεργασία όμως, δεν μπορώ να φανταστώ πώς θα μπορούσε να γίνει αυτό».
Η τιμή και η ασφάλεια οποιασδήποτε θεραπείας γονιδιακής επεξεργασίας θα καθορίσουν αν μπορεί πραγματικά να βοηθήσει όλο τον κόσμο, πρόσθεσε η ερευνήτρια.
«Δυσκολεύομαι να πιστέψω ότι μια γονιδιακή θεραπεία όπως η CRISPR θα είναι ποτέ είτε ασφαλέστερη είτε πιο αποτελεσματική από ένα πολύ απλό χάπι χοληστερόλης», είπε.
Υπάρχει ένας καλός λόγος που οι πρώτες δοκιμές του CRISPR επικεντρώθηκαν σε άτομα με σπάνιες διαταραχές που έχουν λίγες επιλογές, είπε ο Κόμορ.
«Αυτοί οι άνθρωποι έχουν τη μεγαλύτερη ανάγκη», είπε. «Αν και η διεύρυνση των εφαρμογών του CRISPR είναι συναρπαστική, έχουμε ηθική υποχρέωση να βοηθήσουμε αυτούς τους ανθρώπους πριν βοηθήσουμε τον γενικό πληθυσμό», κατέληξε ο Κόμορ.

MIT Technology Review – ertnews.gr




